Niels Henrik David Bohr (ilmuan yang lahir pada 1885 dan wafat pad 1962) membuat teori atom yang sangat fenomenal yang dikenal dengan teori atom Bohr pada tahun 1913. Niels Henrik David Bohr adalah seorang ahli fisika Denmark dan ia pernah mendapat penghargaan nobel pada tahun 1922 dalam fisika untuk struktur dan kuantum atom mekanika. Bohr adalah salah satu ilmuwan paling berpengaruh di abad ke-20.
Sejarah Model Bohr
Model Bohr ditemukan melalui pengamatan Bohr dari spektrum emisi atom hidrogen. Ketika cahaya putih adalah difraksi dengan prisma, semua warna dari spektrum dapat dilihat. Setiap warna berhubungan dengan jumlah tertentu energi. Namun ketika lampu yang dilepaskan oleh atom hidrogen dibiaskan melalui prisma, hanya warna-warna tertentu dari cahaya yang bisa dilihat. Hal ini menyebabkan Bohr berteori bahwa elektron hanya memiliki energi tertentu dalam sebuah atom dan mereka memiliki tingkat energi tertentu.
 Bohr menemukan energi dari warna cahaya yang dilepaskan atom hidrogen. Dia menggunakan energi ini untuk menemukan bahwa energi elektron tunggal dalam atom hidrogen bisa dimiliki. Teori Bohr ini dapat kita katakan sebagai perkembangan dari teori atom dalton.
Bohr menemukan energi dari warna cahaya yang dilepaskan atom hidrogen. Dia menggunakan energi ini untuk menemukan bahwa energi elektron tunggal dalam atom hidrogen bisa dimiliki. Teori Bohr ini dapat kita katakan sebagai perkembangan dari teori atom dalton.
Bohr mengatakan bahwa elektron harus melepaskan energi untuk mengubah energi sehingga perbedaan antara energi cahaya terlihat pada spektrum atom harus sesuai dengan perbedaan energi dari tingkat energi tertentu.
Teori Atom Bohr
Teori Atom Bohr mengambarkan sebuah atom sebagai elemen yang sangat kecil, Nucleus bermuatan positif yang bermuatan yang berisi proton dan neutron dikelilingi oleh elektron bermuatan negatif. Elektron yang bermuatan negatif melingkari orbit dan mengelilingi Nucleus. Secara garis besar model teori Bohr ini memiliki kesamaan dengan solar system. Perbedaannya adalah teori model atom Bohr mengupas elektro berkekuatan statis yang menyediakan gaya tarik ketimbang gaya gravitasi.
Fakta Menarik Model Bohr
- Teori Niels Bohr adalah model atom yang ditemukan dari perbaikan model kubik, model saturasi, model plum-pudding, dan model Rutherford.
- Model Bohr tidak hanya menjelaskan struktur formula Rydberg dan penalarannya, tetapi teori ini juga memberikan analisis yang jelas untuk hasil penyatuannya dalam hal konstanta fisika fundamental.
- Niels Bohr menerapkan struktur atom kuantum Rutherford dan dengan asumsi bahwa elektron dalam orbit stasioner ditentukan oleh momentum sudut yang mereka miliki. Hal ini menyebabkan perhitungan tingkat energi yang mungkin untuk orbit dan postulasi bahwa emisi cahaya terjadi ketika transfer elektron ke tingkat energi yang lebih rendah dari orbit.
- Teori atom Bohr pada dasarnya dianggap sebagai model atom hidrogen primitif.
- Berdasarkan teori atom Bohr, pendekatan pertama dari atom hidrogen dapat diterima sebagai derivasi menggunakan mekanika kuantum yang lebih luas dan jauh lebih akurat.
- Teori Bohr dapat dimanfaatkan dan diterima menjadi teori ilmiah yang mutlak.
Model Teori Atom Bohr
Model Bohr ini terdapat beberapa poin penting yang perlu dipahami, berikut beberapa di antaranya
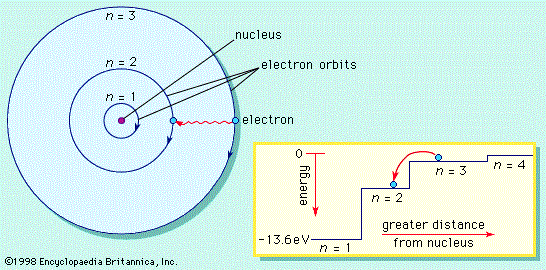
- Elektron mengitari inti atom dalam orbit tertentu yang berbentuk lingkaran. Orbit yang dimaksuda dapat dinamakan kulit elektron yang memiliki notasi K, L, M, N … dst yang secara berurutan sesuai dengan n = 1, 2, 3, 4 … dst.
- Elektron dalam tiap orbit mempunyai energi tertentu yang makin tinggi lingkaran orbit maka makin besarnya harga n. Energi ini bersifat terkuantisasi dan harga-harga yang diijinkan dinyatakan oleh harga momentum sudut elektron yang terkuantisasi sebesar n(h/2π) dengan n = 1, 2, 3, 4 … dst.
- Elektron tidak memancarkan energi selama masih dalam orbit yang disebut dengan stasioner. Keberadaan elektron dalam orbit stasioner ini dipertahankan oleh gaya tarik elektrostatik elektron oleh inti atom yang diseimbangkan oleh gaya sentrifugal dari gerak elektron.
- Elektron dapat berpindah dari orbit satu ke orbit lain yang mempunyai energi lebih tinggi bila elektron tersebut menyerap energi yang besarnya sesuai dengan perbedaan energi antara kedua orbit yang bersangkutan, dan sebaliknya bila elektron berpindah ke orbit yang mempunyai energi lebih rendah akan memancarkan energi radiasi sebagai spektrum garis yang besarnya sesuai dengan perbedaan energi antara kedua orbit yang bersangkutan.
- Atom merupakan molekul yang dikatakan sebagai tingkat dasar (ground state) apabila elektron-elektronnya menempati orbit-orbit sedemikian sehingga memberikan energi total terendah. Apabila elektron menempati orbit-orbit yang memberikan energi lebih tinggi daripada energi tingkat dasarnya maka dapat dikatakan atom pada tingkat tereksitasi (excited state). Atom dalam keadaan dasar lebih stabil daripada dalam keadaan tereksitasi.
Teori Model Bohr Pada Hidrogen
Apabila kita mengamati contoh teori Bohr, yang paling mudah dipahami adalah model Bohr untuk atom hidrogen (Z = 1) atau untuk ion hidrogen seperti (Z> 1), di mana elektron bermuatan negatif mengorbit pada nucleus bermuatan positif. Energi elektromagnetik akan diserap atau dipancarkan jika elektron bergerak dari satu orbit ke orbit yang lain.
Hanya orbit elektron tertentu yang diizinkan. Radius orbit yang memungkinkan akan meningkat dan digambarkan sebagai n; di mana n adalah bilangan kuantum utama.
transisi 3 → 2 menghasilkan baris pertama dari deret Balmer. Untuk hidrogen (Z = 1) ini akan menghasilkan foton yang memiliki panjang gelombang 656 nm (lampu merah).
Kontribusi Teori Atom Bohr
- Niels Bohr mendalilkan teori atom berdasarkan teori kuantum bahwa elektron bermuatan negatif mengitari sekitar inti/necleus bermuatan positif dalam orbit stasioner.
- Teori ini juga menyebabkan level teori energi yang berbeda dalam atom, yaitu jika elektron mentransmisikan dari tingkat orbit yang lebih tinggi ke orbit tingkat yang lebih rendah harus melepaskan energi atau radiasi elektromagnetik.
- Model atom Bohr berkontribusi untuk kemajuan teori kuantum struktur atom dan penelitian mengenai fisika kuantum yang pentingadalah masa depan kita.
Kelemahan Teori Atom Bohr
- Tidak menjelaskan teori efek Zeeman
- Tidak sesuai dengan prinsip ketidakpastian Heisenberg : Teori Bohr mengatakanElektron dianggap harus memiliki radius dan orbit.
- Bohr Model tidak memberikan nilai yang benar untuk ground state sudut momentum orbital
- Sulit mengembangkan prediksi atas spektrum atom yang lebih besar.
- Tidak memprediksi intensitas relatif dari garis spektrum.
- Teori atom Bohr tidak menjelaskan struktur halus dan struktur hyperfine dalam garis spektrum.
Perkembangan teori kimia ini dapat menjelaskan mengenai berbagai fenomena alam seperti fatamorgana dan berbagai reaksi kimia lainnya. Dengan bantuan alat-alat laboratorium kimia maka diharapkan teori atom ini dapat berkembang lebih pesat untuk kemajuan ilmu fisika.
Advertisements
